�����YӍ
|
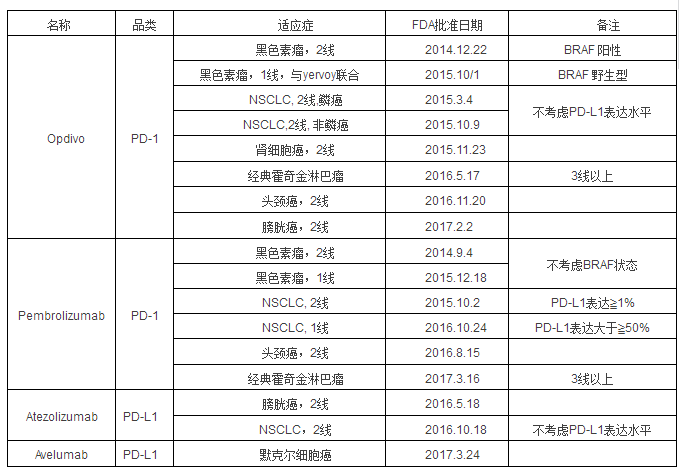
�������Ƅ�PD-L1��TMB�z�y�F(xi��n)�δ���l(f��)չ����时间��2017-07-03 作者��pd1��转载�� ����ᘌ��������ݵĶ�N�[�������ί������аl(f��)�У������ί��ж����h(hu��n)��(ji��)���h�h��(f��)�s�ڰ����ί����������ߏĿ�ԭ��ጷš������f�ʺͼӹ����Լ���T���������ȣ������h(hu��n)��(ji��)���F(xi��n)���}�������܌�(d��o)���������ݡ������ί������Mչ�������ߙz���c���[�������У��z���c��ؓ���{(di��o)��(ji��)������ʹ���������[������ҕ����Ҋ�������ί���ǰ�����[�����и�����ԭ�ԣ�NSCLC������ԭ�Էdz��ã����PD-1��PD-L1���Ƅ���2015����ٰl(f��)չ�� ����2016��8�£�BMS�������������顰CheckMate 026���������R��ԇ�ĺ��Ĕ�(sh��)��(j��)����PD-L1���_>5%��NSCLC�����У�Opdivo��Ȼ�����PFS���o�Mչ�����ڣ�4.2��5.9���£���OS���������ڣ�14.4��13.2���£����]���@����ߡ����^Ĭɳ�|��˾��ͬ�ˎ��Keytruda������PD-L1���_>50%��NSCLC����������Mָ��(bi��o)�����顰Keynote024�����R��ԇ��У�ORR��PFS����OS����٣�����NSCLCһ���m��(y��ng)�Y����ˣ�BMS��Ʊ��ֵһ�ȵ���20%��BMS�ēpʧ�ɾ��˸������ֵ���ֵ���L��BMS��˾�ԑKʹ�Ĵ��r��������ߣ�PD-L1���_>5%����һ���õ�ָ��(bi��o)�� ������(j��)AACR2017�������棬�о��ˆT����TMB���[��ͻ׃ؓ�ɣ������(bi��o)־�CheckMate026�����R��ԇ��M�л�����о����Y(ji��)���@ʾ�����PD-L1���x��TMB����Opdivo�ί�NSCLC��biomarker���ܸ��õ^(q��)�֫@����Ⱥ��ԓ�о��l(f��)�F(xi��n)����TMB�߱��_�IJ����У�����Opdivo�M���ί���ORR�����^������47%vs. 28%����PFS���o�Mչ�����ڣ�9.7��vs.5.8�£��Y(ji��)���@����(y��u)�ڻ������@һ�Y(ji��)����BMS��˾��Opdivoˎ������NSCLCһ����ˎ������ϣ���������A(y��)Ҋ��δ�팢�и���ˎ������]��TMB�{��ICIsˎ���R��ԇ�ęz�y������ ��������(zh��n)�t(y��)�W(xu��)ʼ�ڰ����ί��������ί�һ�_ʼ��˼���ܷ����ð����ί��ijɹ�֮·�����^ȥ��NSCLCֻ��һ�N��͵ļ������˂��ǻ��ڽM���W(xu��)�M�л����������Ƅ����x�F(xi��n)�ڣ�����(j��)�[������W(xu��)���������ڷ��ӷ��ͣ��M�Ђ��w���ľ���(zh��n)�����ί��� �����F(xi��n)�ڣ�������������ί�2.0�r�����������ί����^ȥ���^�ַŵ��ί������F(xi��n)�ڻ������ߙz���c�Ćο�¡���w����ί����@���^ȥ���˾���w�S���M��������PD-1/PD-L1���Ƅ������ߙz���c߀�кܶ���Ҫ̽��������CD8+T������Ⱥ�ęz�y�Ƿ��c��Ч���A(y��)�����P(gu��n)���о��l(f��)�F(xi��n)���������[�����[��ͻ׃ؓ���c��Ч���A(y��)�����P(gu��n)�� ����1��PD-L1 ���������҂����˽�һ��ʲô��PD-L1��PD-L1��һ�N���_�ڼ�������ĵ��ף��ַQB7-H1���ף�����CD274�������_���������cЧ��(y��ng)T�����ϵ�PD-1��B7.1�Y(ji��)�ϣ�����(d��o)����������̖����������Ч��(y��ng)T�����Ļ��ԡ�PD-L1���S����͵ļ����б��_������̥�P��Ѫ�܃�(n��i)Ƥ�������ȍu���������⡢�μ�������Ƥ�������g���|(zh��)�ɼ������Լ�B������T��������ͻ��������ɼ������ʴ�����PD-L1���[����������ı��_�t�ɞ����[����Ó������������[�����L���(q��)�����ء� ����PD-L1���[�������ı��_�C���ЃɷN���M���ԏV�������У����_���m��(y��ng)�Ծ۽����_�����б��_������°�������̖ͨ·��׃�����PD-L1�ĽM���Ա��_�����_�㶨���m��(y��ng)�Ծ۽����_�������������ڵĴ��װY������IFN-�õ������±��_���DŽӑB(t��i)׃���ġ��@�ɷN���_�C�Ʋ��ų⣬PD-L1�Ĺ��б��_�����װY���������±��_���{(di��o)�� �����������ϙC���� PD-L1�ęz�y�ǻ��ڼ�������ˮƽ�ęz�y������R��ԇ��������߽M������������Ҳ���Ǵ�������g(sh��)�̺�ȡ�õ��[���M���M����ƬȾɫ��ͨ���ڲ��������@ʾ�����߽M���Ǚz�y���ױ��_�Ľ�(j��ng)���ַ�����ͨ�^���w��ɫ���ɲ����t(y��)���R���^�����(j��)��ɫ��\���u�r���_��r����˳���Ⱦɫ���g(sh��)�⣬���w���خ���Ҳ������Ҫ����Ŀǰ�҇�PD-L1�z�y���^��y��һ��Ⱦɫ���g(sh��)���l���IJ��y(t��ng)һ������Ⱦɫ�Ŀ��w���ӣ����Dz����u�r��(bi��o)��(zh��n)��δ�y(t��ng)һ���@Щ����(d��o)����(n��i)���ߙz�yPD-L1�ărֵ�p�͡� ���������о��@ʾ��PD-L1�ı��_�cPD-L1/PD-1���Ƅ��į�Ч���P(gu��n)���S��PD-L1���_���߯�Ч���ӣ��������ƕr�g���L�������A(y��)����ơ� ����1.1 PD-L1�z�y���R���rֵ ����������Ŀǰ��F(xi��n)DA�ѽ�(j��ng)����(zh��n)��4��PD-1/PD-L1���Ƅ�����7�ͬ�[�����ί����±��г�����(zh��n)�ĕr�g�ͻ����m��(y��ng)�Y������(zh��n)�m��(y��ng)�Yȫ�QՈ���FDA�ٷ��W(w��ng)վ����
�������QƷ��m��(y��ng)�YFDA����(zh��n)���ڂ�ע ����Ŀǰ�Ј����@�ķN�ο��z�y�Ƿ���пɱ��ԣ��Ƿ����ͨ�ã��z�y���g(sh��)��IHC��һ�N�x����Ventana��һ�N��Dako�������u�r�������[���������[��������������������u�r�����ί��rҪ���]�ο�ˎ��z�y������cutoffֵ����Ϣ���F(xi��n)�ڣ�50%�߱��_�H����Ĭɳ�|�ęz�y�����������Ƿ��c��������ͨ�ã�Ŀǰȱ��ѭ�C�t(y��)�W(xu��)�C��(j��)�� �����_�φο�ˎ����Atezolizumab�����cPD-L1��PD-L1 ICH�z�yʹ��Ventana SP142���u�r�ļ������[���������[��������������cutoffֵ����1%��5%��50%��III��OAK�о��@ʾ��PD-L1�߱��_��Ⱥ�A���ڏ�Atezolizumab�ί��Ы@�ø����OS�@�棬�����S�����_�ʵ����ߣ��@�������PD-L1��ԁ��M�У�Atezolizumab��ȶ�����ِδ�����ORR�� ����ʩ�F����Nivolumab���cPD-1���z�yʹ��Dako28-8��cutoffֵ��1%��5%��III��CheckMate057�о��@ʾ��PD-L1�ı��_ˮƽ�c���[NSCLC���ߏ�Nivolumab�ί���OS�@��������P(gu��n)��III��CheckMate017�о��@ʾ��Nivolumab���[�������еį�Ч�cPD-L1�ı��_ˮƽ�o�P(gu��n)�� ������������Pembrolizumab�ο������cPD-1��PD-L1IHC�z�yʹ��Dako 22C3���u�r�����[��������cutoffֵ��1%��50%��III��KEYNOTE010�о��@ʾ��PD-L1�߱��_��Ⱥ����Pembrolizumab�ί��������L(f��ng)�U�½����ࡣPD-L1���_��Pembrolizumab���P(gu��n)��Ҫ��PD-L1����ԵĻ�����������һ��ʹ�á� ����1.2 ��ζ��x���_�� ����PD-L1�z�y����ԍ���ĵط�֮һ��ȱ����(bi��o)��(zh��n)���ѽ�(j��ng)�@���������о��еĿ�PD-1�ί�������atezolizumab��durvalumab�����Լ�����PD-L1�z�y�������}�ǣ�ÿ�N�z�y���õ��Ŀ��w�;��w���g(sh��)����ͬ����(d��o)��PD-L1��ԵĶ��xֻ����(y��ng)��ˎ���Լ��Ę�(bi��o)��(zh��n)�������mȻ���еęz�y���������[��������PD-L1Ⱦɫ��r����atezolizumabͬ�r��Ҫ�u�����߽���������PD-L1��B(t��i)��ᘌ��z�y��(bi��o)��(zh��n)�Ć��}���������H�ΰ��о��f(xi��)���ڃ�(n��i)�Ķ������H�M������Ŭ�����M��ͬPD-L1���_�z�y���g(sh��)�����������܉��ṩ��ͬ�z�y�g�ɿ��ľ��ܶȌ��Ȕ�(sh��)��(j��)�� �������R��ԇ��У� Keytruda��opdivo���x��PD-L1���_�Ľy(t��ng)Ӌ��(bi��o)��(zh��n)����Ҫ�ٷֱȞ��(bi��o)�ߣ�����������100���[�������İ����У����_PD-L1���[������ռ�����[�������ı�������˳��F(xi��n)��PD-L1���_�İٷֱ�֮�f���D����PD-L1���_��1%��1%-49%��50%�IJ�ͬ�R�D���Sɫ����ɫ��λ�����_PD-L1�ļ�������ABC��ͱ��R�£�DEF��߱��R�£��� ������atezolizumab�ί�NSCLC���R��ԇ��У��������z�y�c��ֻ�������[��������PD-L1���_��߀ͬ�r�u�r���[���h(hu��n)���н�������������PD-L1�ı��_��r����������TC��IC�ɂ���(bi��o)��(zh��n)��ԇ�Y(ji��)�����ɂ��A(y��)�yָ��(bi��o)����Ч���Ъ����A(y��)�y�rֵ���@��Ҫ�����w��(n��i)�����������{(di��o)��(ji��)T����Ҳ���c�����߭h(hu��n)�����{(di��o)�ء��@Ҳ��ʾPD-L1�ęz�y���ںܶ�������ˡ� ����1.3 PD-L1�z�y�Ć��}�c����(zh��n) ����PD-L1�z�y���ڵĆ��}�У�����W(xu��)���棬�����g������(n��i)���|(zh��)�ԣ����A(y��)�ί�Ӱ푱��_���Լ�������͡�Ⱦɫ��λ�ȣ��z�y���g(sh��)���棬�粻ͬ�ęz�y���w��ƽ�_����ͬ���ֵ���M����Դ���棬�M����ͣ�ԭ�l(f��)��λ�c�D(zhu��n)��������W(xu��)��(bi��o)������(bi��o)���|(zh��)���ȡ��@Щ���ܕ��ɔ_PD-L1�ęz�y�Y(ji��)������Ҫ�����R���о��M���C���� ��������AACR��IASLC��4�ҹ�˾(li��n)���ƶ����{ӡӋ����Ŀ�ľ��DZȌ��ķN�ο��ęz�y�Y(ji��)�����{ӡӋ����39��NSCLC��(bi��o)�����^4��ԇ���z�y�ĽY(ji��)������Ⱦɫ���棬28-8��22C3��SP263�@ʾ�����Ƶ��[���������Ⱦɫ�ٷֱȣ�SP142Ⱦɫ��Ե��[�������^�٣�4�Nԇ������������Ⱦɫ��һ�����^�����R���\��棬4�Nԇ����ȫһ�µ�ֻռ19%�� ��������һ�����о��@ʾ��4�Nԇ�����[������Ⱦɫ֮�g��һ�����^�ߣ�������ɫһ�����^� ����AZ���^�о���500����(bi��o)�����^��28-8��SP263��22C3���[������Ⱦɫ���Y(ji��)���@ʾ3�Nԇ��֮�g��һ�����^�ߡ� ����2016��ESMO������������ӱ�����NSCLC PD-L1�z�y��(sh��)��(j��)������4784��NSCLC���о��ó�4헽Y(ji��)Փ���[�����ٰ��ı��_�ֲ����ƣ���(j��ng)�κͳ�����Ⱥ�ı��_�ֲ����ƣ�ԭ�l(f��)��λ���D(zhu��n)����ı��_�ֲ����ƣ����r��(bi��o)���ʹ�n��(bi��o)���ı��_�ֲ����ơ� ����FDA�@����PD-1/PD-L1���Ƅ���PD-L1�ęz�yҪ���ڲ�ͬ�[������(j��)��ͬ��ѭ�C�t(y��)�W(xu��)�C��(j��)����(zh��n)����Nivolumab�����ί��o��PD-L1���_�z�y�������h�a���\�࣬Atezolizumab�����ί�Ҳ����ҪPD-L1���_�z�y��Pembrolizumabһ���ί�PD-L1��50%�������ί���1%�� ����2�[��ͻ׃ؓ�� �������ѽ�(j��ng)����(zh��n)���m��(y��ng)�Y���P(gu��n)�I�R���о��ṩ���C��(j��)������PD-L1�ı��_�Ƿ����ָ��(d��o)�R����ˎ���x��@����Ⱥ���Y(ji��)ՓĿǰ߀��һ�£��@������һ����(c��)����ʾPD-L1���_߀����һ��������bio-marker���о��^��ĝ���bio-marker ���[��ͻ׃ؓ�ɣ�tumor mutation burden, TMB�����l(w��i)�Ǹ߶Ȳ���(w��n)����microsatelliteinstability-high, MSI-H�����e������ޏ�(f��)ȱʧ��mismatch-repair deficiency��MMR�����@Щ���ڵ�bio-marker��ָ��һ����ͬ�cͻ׃���P(gu��n)�¿�ԭ��mutation-associated neoantigen������CTLA-4�ڐ��Ժ�ɫ�������о��c��PD-1��NSCLC���о��Mһ���f���R�eͻ׃���P(gu��n)�¿�ԭ�������������[�����߷���(y��ng)�ĺ���Ҫ�ء� ����2.1����֪�R �����[��ͻ׃ؓ�ɣ�TMB���漰���ɂ���Ҫ����germline mutation���Nϵͻ׃����ϵͻ׃����somatic mutation���w����ͻ׃��������BioNinjia�ĈD��һĿ��Ȼ��ԏጶ��ߵ��P(gu��n)ϵ�c�^(q��)�e����ϵͻ׃������һ���������z��������Ѫ�Ѳ���砵�����ؚѪ�ȡ� �����DƬ��̎Somatic vs Germline Mutations ����Somaticͻ׃?y��u)�@����ͻ׃�����T׃����Ӱ��°l(f��)��ͻ׃���ɱ��F(xi��n)��RNA�͵���ˮƽ���a(ch��n)�����¿�ԭ�����±�λ��������Ƭ�Ρ��Ķεȱ���������ϵ�y(t��ng)�R�e������ң�non-self����ԭ������T�������������߷���(y��ng)�� �����w����ͻ׃�����ܵ���Դ���T׃���ص�Ӱ푣�����ΰ��П��ݣ��������T��(d��o)��C��A��ͻ׃�����Ժ�ɫ�����У����⾀���������C��T��ͻ׃����(n��i)Դ�����������ͻ׃������DNA�e���ޏ�(f��)ͻ׃������Y(ji��)ֱ�c����ʳ�ܰ��е�MSI���l(w��i)�Dz���(w��n)�������ڌ��w�[���У�95%��ͻ׃?y��u)���A������Q����ɵķ�ͬ�xͻ׃��һ��������ͻ׃��׃һ�����İ���������e�xͻ׃����ͬ�x�cͻ׃�����������׃��(d��o)��һ���ܴa�Ӿ��aһ����ͬ�İ����ᣩ�͟o�xͻ׃����ͬ�x�cͻ׃ʹһ���ܴa��׃?y��u)�Kֹ�ܴa���������机ϳ���ǰ�Kֹ������ͬ��(g��u)�����w������ͬ�xͻ׃�Ļ���Ҫ�ء� ����2.2 TMB���x�� ����ȫ����M��Ӌ����ϵDNA׃�w���w����ͻ׃��(sh��)Ŀ������Lawrence,MS�F���Nature�ϰl(f��)�����о��У������^100��ͻ׃/Mb�Q֮���TMB�� ����2.3 �R���о� ����Tumor Mutation Burden ָ��(d��o)�R���о����ѽ�(j��ng)ȡ�õijɹ���ͻ׃ؓ��Խ�ߣ��ί���(y��ng)��Խ�ã��Еr�[�������(f��)�s���[��ͻ׃ؓ�ɸ��ߵİ��Y�����ί���(y��ng)������ã��@ �����������c����˼�h�� ������PD1�Ϳ��������������w��PD-L1���z���c���Ƅ����������ڼ�����[��ͻ׃ؓ�ɰ��Y���ߵ�����ϵ�y(t��ng)��������w��(n��i)���ڴ����[���¿�ԭ��һ�����¼����������ϵ�y(t��ng)�������Ж|���ɿ����� �����ڳ�ʼ��C����C�M����65�����ߣ��������ί��o푑�(y��ng)�Ļ��ߣ����ί���푑�(y��ng)�Ļ��߶������^�ߵ�ͻ׃ؓ�ɡ����⣬��ͻ׃ؓ�ɽM�����С���ͻ׃ؓ�ɽM���ڿ��^����(y��ng)�ʡ��o�Mչ�����ںͿ��������о��^�ߡ� �������߯�����(y��ng)��� �����[��ͻ׃ؓ�����߯�����(y��ng)���ʣ�%�� ������4 �����е�26 ������45 �����dz���67 ����2.4 TMB�ɞ�bio-marker�ă�(y��u)�c�c���� ����TMB���ԙM������[���M�ЙM��������ɝ�����e���w��ͻ׃ģʽ���Ɯy�¿�ԭؓ�ɣ��߸��w���c���ԙz�y����Ҋ���w����ͻ׃����ͨ���������Ԟ���֪�(q��)��ͻ׃�����磬EGFR,ALK��ROS1�ȣ���TMB�������������������x��IO�ί��߫@����Ⱥ�� ����TMB�������g(sh��)Ҫ��ߺ͕r�g�ܼ���NGS����ȫ���@�ӽM�y�r���F���t(y��)������(zh��n)����(sh��)��(j��)��(f��)�s��Ҫ������Ϣ�W(xu��)���ҽ��x�����R��NGS���g(sh��)����(zh��n)�У�ʯϞ����M��DNA/RNA���⣻TMB��Ҫ�и�����R���C��(j��)�f���c���ߙz���c���Ƅ���Ч֮�g���P(gu��n)ϵ��TMB���靓�ڵ�bio-marker��cut off��Ҫ���x�� ����������֮��TMB�ǝ��ڵ��A(y��)�yIO��Ч��bio-marker��NGS��next generation sequencing���������ڙz�yTMB���x���ȫ����M�y��ȫ���@�ӽM�y����x���Ի���y����TMB�ѽ�(j��ng)���C���cCTLA-4���Ƅ��ί���ɫ������PD-1/PD-L1���Ƅ��ί���ɫ���������װ���NSCLC���R����Ч���P(gu��n)��TMB���靓��IO biomarker���R���о������M���У���Ҫ̽���cPD-L1���_���[�������h(hu��n)������֮�g���P(gu��n)ϵ�� ����2.5 ��Ιz�y�[��ͻ׃ؓ�� ����TMB���[��ͻ׃ؓ�ɣ���һ����d���\�ʽ�����Ԏ����A(y��)�y�����ί���ijЩ�[���е�푑�(y��ng)������ΰ������װ��ͺ�ɫ������ ��������Foundation�ͷ�����W(xu��)�ĺ������ѽ�(j��ng)������ʹ��TMB������(sh��)��(j��)֧�֣�����foundation oneȫ��Ļ���M������һ���֣���ȫ��Ψһ���Ԏ����A(y��)�yPD-1/L1���ί�Ч���ęz�y���@헽Y(ji��)���������ӵ��������C��(j��)�У����������߿���ͨ�^TMB�A(y��)�y�����ί��ī@��̶ȣ��@Ҳ�҂����ӽӽ����Ļ����������ί��������Ŀ��(bi��o)�����R���t(y��)���ж������Ƿ��m��ʹ��PD-1/PD-L1�ṩ����(j��)�� ����Ŀǰ���ܶ��R���о����@ʾ��TMB�����A(y��)�y�����ί��į�Ч����Nivomulab��Pembrolizumab��Atezolizumab�����@Щ�R��ԇ��в��ò�ͬ�ęz�yƽ�_�M��TMB�z�y���Ҹ�TMB��cut-offֵҲ������ͬ�������Ҫǰհ�Ե����R���о��Լ��R�����`�У�̽�����о���ѵęz�y������cut-offֵ�����⣬PD-L1���_ĿǰҲ�DZ��^����������A(y��)�yָ��(bi��o)��TMB�cPD-L1��θ��õ�(li��n)�ϑ�(y��ng)�ã��Ķ��Y�x��ѵ������ί��@����Ⱥ��Ҳ��δ����Ҫ̽�������c�� �����[�����h(hu��n)���dz���(f��)�s���漰���[���������[��Ѫ�ܡ��������Լ��[���g�|(zh��)�ȣ�����֮�g���P(gu��n)ϵ����Ҫ�M�����_�����P(gu��n)���о���δ����Ҫ�����[���h(hu��n)�����������������(bi��o)ӛ���о��� �������ÿ��l(f��)����H��ˎ�ӑB(t��i)�������(n��i)�����ṩȫ��������ˎƷ����ԃ����(w��)���������ˎӡ�ȼ��������ΰ���ˎӡ�ȶ༪����PD-1��PD-L1���ΰ�AZD9291�ȣ���������(n��i)�����x����¸���Ч���ί�ˎ����ֶΣ�����ˎƷ��Ϣ��ُˎ������Ԕԃ��400-001-9763,010-67385800���ţ�headkonhdk �� |
|
|