更多資訊
|
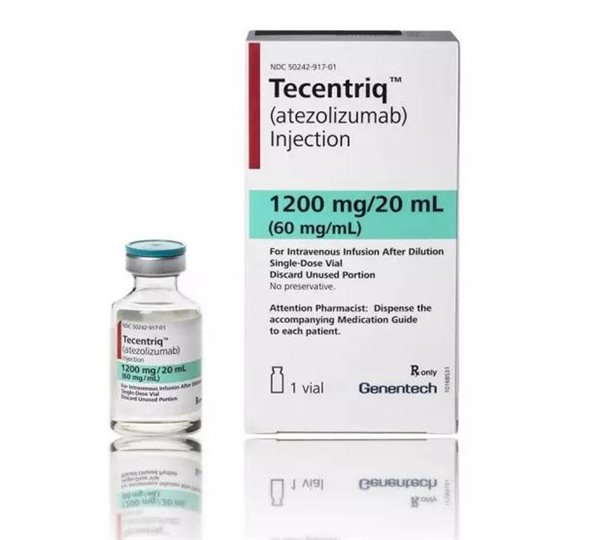
轉移性尿路上皮癌有新藥-阿特珠單抗Tecentriq,效果及如何購買?时间:2018-09-05 作者:轉移性尿路上皮癌,阿特珠單抗,Tecentriq,效果,購買【原创】 阅读 阿特珠單抗Tecentriq(atezolizumab)是一種PD-L1免疫療法,這是一種全人源化單克隆抗體,旨在靶向腫瘤細胞和腫瘤浸潤免疫細胞表面表達的PD-L1蛋白,阻止其與T細胞表面的PD-1和B7.1受體結合。通過抑制PD-L1,atezolizumab能夠使T細胞激活。 轉移性尿路上皮癌(mUC)治療選擇有限,預后很差。尿路上皮癌(UC)是全球第9大常見癌癥,每年新增43萬例,死亡超過16.5萬例,男性發病率為女性3倍。阿特珠單抗Tecentriq將為轉移性尿路上皮癌患者群體提供一種重要的治療選擇。 瑞士制藥巨頭羅氏(Roche)PD-L1免疫療法Tecentriq(阿特珠單抗)獲得美國食品和藥物管理局(FDA)批準,用于不適合順鉑化療的局部晚期或轉移性尿路上皮癌(mUC)患者。 另外,FDA還批準阿特珠單抗Tecentriq用于接受含鉑化療治療期間或治療后病情進展、以及接受靶向療法(若腫瘤中存在EGFR或ALK基因異常)治療失敗的轉移性非小細胞肺癌(NSCLC)患者。阿特珠單抗Tecentriq成為FDA批準治療轉移性NSCLC的首個也是唯一一個抗PD-L1免疫療法。
膀胱癌是最常見類型的尿路上皮癌(UC),據估計,有多達50%的晚期患者無法接受順鉑化療作為初始治療方案,因此該領域存在著高度未獲滿足的醫療需求。除了膀胱癌之外,尿路上皮癌也包括尿道、輸尿管、腎盂部位的癌癥。 IMvigor210研究是一項開放標簽、多中心、單組II期臨床研究,評估了阿特珠單抗Tecentriq用于局部晚期或轉移性尿路上皮癌(mUC)的療效和安全性。 研究中,患者納入了2個隊列: 隊列1為既往未接受治療以控制局部晚期或mUC病情的患者,以及不適合順鉑化療方案的患者; 隊列2為含鉑化療治療期間或治療后(二線或多線)病情進展的患者。 該研究中,隊列1的119例患者每3周進行一次靜脈輸注1200mg劑量阿特珠單抗Tecentriq,直至不可接受的毒性或病情進展。 來自隊列1的數據顯示,阿特珠單抗Tecentriq治療的客觀緩解率(ORR)為23.5%,其中完全緩解率(CR)為6.7%,部分緩解率(PR)為16.8%;在實現緩解的患者中,在數據分析時,中位緩解持續時間(DoR)尚未達到(范圍:3.7個月-16.6個月以上)。
PD-1/PD-L1免疫療法是當前備受矚目的新一類抗癌免疫療法,旨在利用人體自身的免疫系統抵御癌癥,通過阻斷PD-1/PD-L1信號通路使癌細胞死亡,具有治療多種類型腫瘤的潛力。 海得康提醒: PD-1單抗Tecentriq屬于腫瘤處方藥物,具有一定毒副作用,需在具有藥品使用經驗的醫生的指導下使用,同時境外處方藥管制嚴格,且該藥物需要冷鏈運輸,最好能親自去香港就醫購買使用。 海得康不賣藥,如需了解以上藥品價格及出國就醫等更多問題,可以咨詢海得康:400-001-9763、010-67385800。 “海得康”品牌創立于2015年9月,隸屬于北京海德康管理咨詢有限公司,是一家專業的海外醫療服務咨詢機構,為中國患者提供專業、高品質、可信賴的一站式醫療咨詢服務。公司由多年醫藥背景的海歸人員創辦,并獲得了“北京市海外學人中心留學生創業基金”和“中關村國家自主創新示范區海外人才創業支持資金”。
|
|
|