|
貝組替凡在中國納入優(yōu)先審評,何時能上市?时间:2025-05-19 作者:醫(yī)學編輯陳筱曦 阅读 本文聚焦貝組替凡在中國納入優(yōu)先審評一事,介紹其基本信息、納入優(yōu)先審評情況,結(jié)合臨床試驗數(shù)據(jù)與審評流程,對其上市時間進行合理推測,為關(guān)注該藥的患者和醫(yī)療從業(yè)者提供參考。 貝組替凡;優(yōu)先審評;上市時間
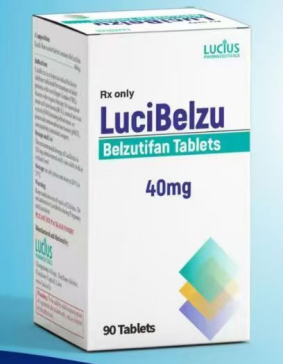
貝組替凡基本信息 貝組替凡(Belzutifan)是一種新型、選擇性小分子缺氧誘導因子2α(HIF-2α)抑制劑,由默沙東公司研發(fā)。它通過抑制HIF-2α的活性,阻斷其下游信號通路,抑制腫瘤細胞的增殖、血管生成和代謝,從而達到治療腫瘤的目的。在VHL綜合征患者中,由于VHL基因突變,HIF-2α無法正常降解而過度積累,促進腫瘤生長,貝組替凡能夠特異性地結(jié)合并抑制HIF-2α,為這些患者帶來了新的治療希望。 納入優(yōu)先審評情況 2024年2月,中國藥品監(jiān)督管理局藥品審評中心(CDE)網(wǎng)站公布,默沙東的貝組替凡片已在華提交上市申請,并被納入優(yōu)先審評序列。其適應(yīng)癥主要針對von Hippel-Lindau(VHL)病相關(guān)的腎細胞癌(RCC)、中樞神經(jīng)系統(tǒng)(CNS)血管母細胞瘤或胰腺神經(jīng)內(nèi)分泌腫瘤(pNET)。這一舉措體現(xiàn)了國家對罕見病治療藥物的重視,有望加快貝組替凡在中國的上市進程。 臨床試驗數(shù)據(jù)支撐 在臨床試驗中,貝組替凡展現(xiàn)出了顯著的療效。在針對VHL病相關(guān)腎細胞癌的2期LITESPARK-004研究中,客觀緩解率(ORR)達到49%,且大多數(shù)患者表現(xiàn)出持久的治療反應(yīng)。在VHL病相關(guān)中樞神經(jīng)系統(tǒng)血管母細胞瘤患者中,ORR為63%,73%的患者至少維持緩解12個月;在VHL病相關(guān)胰腺神經(jīng)內(nèi)分泌腫瘤患者中,ORR為83%,50%的患者至少維持緩解12個月。這些數(shù)據(jù)為貝組替凡的上市提供了堅實的臨床依據(jù)。 上市時間推測 藥品的上市時間受到多種因素的影響,包括審評進度、臨床試驗數(shù)據(jù)的完整性、生產(chǎn)工藝的穩(wěn)定性等。一般來說,優(yōu)先審評的藥品審評時間會相對縮短。根據(jù)以往的經(jīng)驗,優(yōu)先審評的藥品從提交上市申請到獲批上市,通常需要6—12個月的時間。然而,由于每個藥品的情況不同,實際上市時間可能會有所差異。 考慮到貝組替凡的臨床試驗數(shù)據(jù)較為充分,且其針對的VHL病相關(guān)腫瘤患者群體具有迫切的治療需求,預(yù)計貝組替凡有望在2025年下半年或2026年上半年在中國獲批上市。當然,這只是一個大致的推測,具體的上市時間還需以國家藥品監(jiān)督管理局的官方公告為準。 對患者的意義 貝組替凡納入優(yōu)先審評并有望盡快上市,對于VHL病相關(guān)腫瘤患者來說無疑是一個好消息。目前,針對這些疾病的治療手段相對有限,貝組替凡的出現(xiàn)為患者提供了一種新的治療選擇,有望改善患者的預(yù)后和生活質(zhì)量。同時,這也將推動國內(nèi)罕見病治療領(lǐng)域的發(fā)展,為其他罕見病藥物的研發(fā)和上市提供借鑒。
貝組替凡仿制藥已在老撾上市,仿制藥是一種治病的新選擇,如需購買,可自行出國就醫(yī), “海得康”作為一個專業(yè)的醫(yī)療咨詢平臺,為患者提供有關(guān)該藥物的詳細信息和個性化建議。海得康有著豐富的國際新藥動態(tài)知識和經(jīng)驗,能夠為國內(nèi)患者提供全球已上市藥品的專業(yè)咨詢服務(wù)。如有需要,可以撥打服務(wù)熱線400-001-9769或海得康官方微信15600654560來獲取幫助。請注意,所有關(guān)于藥物的使用和副作用的信息都應(yīng)僅作為參考,并不應(yīng)替代醫(yī)生的專業(yè)建議。在決定使用或更改任何藥物治療方案之前,務(wù)必與醫(yī)生進行充分的溝通和討論。
|