|
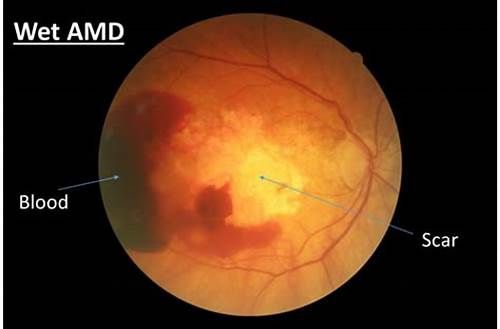
眼科藥物Beovu上市,有效減少失明風險,brolucizumab如何購買使用?时间:2019-10-12 作者:海得康醫學編輯劉曉曦【原创】 阅读 2019年10月,FDA批準新一代眼科藥物Beovu(brolucizumab,又名RTH258),用于治療濕性年齡相關性黃斑變性(wet-AMD,又名新生血管性AMD,nAMD)。值得一提的是,諾華使用了一張優先審評券(PRV)來加速Beovu的監管審查,將其審查周期由常規的10個月縮短至了6個月。 AMD是導致失明的主要原因,影響著全球2000多萬人,頻繁的注射是AMD患者放棄治療的常見原因。Beovu是FDA批準的首個也是唯一一個與再生元重磅眼科產品Eylea(aflibercept,阿柏西普)相比能更大程度地減少視網膜液、同時在符合資格的wet-AMD患者中在3個月加載期(loading phase)之后以每3個月一次給藥間隔治療不影響療效的抗VEGF藥物,可通過減少頻繁注射提高患者的治療依從性,從而有效維持患者視力。
Beovu的活性藥物成分為brolucizumab(RTH258),這是一種人源化單鏈抗體片段(scfv),靶向所有類型的血管內皮生長因子-A(VEGF-A)。單鏈抗體片段因其體積小、組織滲透性增強、系統循環的快速清除、藥物遞送特性而在藥物開發中受到高度關注。 brolucizumab的創新結構使其僅有26kDa大小,針對VEGF-A所有亞型均有很強的抑制作用,并具有很高的親和力。在臨床前研究中,brolucizumab通過阻斷配體-受體相互作用來抑制VEGF受體的激活。增加的VEGF途徑信號與病理性眼部血管生成和視網膜水腫有關。在脈絡膜視網膜血管疾病患者中,抑制VEGF途徑可抑制新生血管病變的生長,緩解視網膜水腫,改善視力。 現有的眼科治療產品標簽表明,每12周(3個月)一次給藥方案療效欠佳。Beovu是首個在治療的第一年能提供較少的給藥頻率同時維持治療有效性的藥物。 此次批準,主要基于III期HAWK研究(NCT02307682)和HARRIER研究(NCT02434328)的數據。這2項研究是在wet-AMD患者中前瞻性地證實Beovu以每12周一次(3個月一次)給藥方案啟動治療表現出顯著療效的首批也是唯一一批全球性頭對頭臨床研究。
濕性AMD(wet-AMD) 2項研究均為前瞻性、隨機、雙盲、多中心研究,在wet-AMD患者中開展,評估了Beovu相對于Eylea的療效和安全性。2項研究中,符合資格的患者可以在加載期后立即給予3個月給藥間隔的維持治療。在第一年,超過一半的患者維持3個月給藥間隔(HAWK研究56%,HARRIER研究51%),其余患者按照2個月給藥間隔方案進行治療。 結果顯示,2項研究均達到了主要終點,在治療第一年(第48周),Beovu(6mg)在改善視力方面療效非劣效于Eylea,具體數據為:HAWK研究和HARRIER研究中,Beovu(6mg)治療組最佳矯正視力(BCVA)相對基線的平均變化分別為6.6個字母(Eylea治療組為6.8個字母)和6.9個字母(Eylea治療組為7.6個字母)。2項研究中,大約30%的患者在治療一年時BCVA提高至少15個字母。 此外,Beovu(6mg)在疾病進展關鍵指標的3個次要終點方面也表現出優勢:疾病活動度、中央視野視網膜厚度、視網膜液(視網膜內液和/或視網膜下液)。具體數據為: (1)在治療第48周,與Eylea治療組相比,Beovu(6mg)治療組疾病活動的患者比例更低(HAWK研究:23.5% vs 33.5%,p=0.0022;HARRIER研究:21.9% vs 31.4%,p=0.0022); (2)在治療第48周,與Eylea治療組相比,Beovu(6mg)治療組視網膜液關鍵標志物顯著減少:存在視網膜內液(IRF)和/或視網膜下液(SRF)的患者比例方面,HAWK研究中減少31%(p<0.0001)、HARRIER研究中減少26%(p<0.0001)。 海得康由多年醫藥背景的海歸人員創辦,經過多番實地考察與印度大型醫院:FORTIS富通醫院和MEDANTA醫院等,建立了官方合作關系。海得康醫學顧問咨詢電話:400-001-9769,微信號:hdk4000019769。 免責聲明:海得康不賣藥,只為患者提供出國就醫咨詢服務,用藥需由專業醫師指導。
|