|
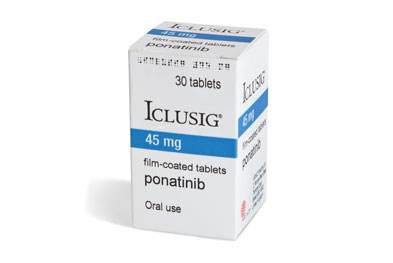
普納替尼組合治療新診斷的費城染色體陽性急性淋巴細胞白血病,效果,副作用,用法时间:2024-03-22 作者:醫學編輯李可艾 阅读 FDA已加速批準普納替尼(Iclusig)與化療聯合治療新診斷的費城染色體(Ph)陽性急性淋巴細胞白血病(ALL)成年患者。
支持該適應癥批準的結果來自PhALLCON3期試驗(NCT03589326)。 在多中心、開放標簽PhALLCON試驗中,245名新診斷為Ph陽性ALL的成年患者以2:1的比例隨機分配接受每天兩次口服30毫克普納替尼或每天口服一次600毫克伊馬替尼聯合化療。研究人員進行了3個周期的長春新堿加地塞米松誘導治療、6個周期的甲氨蝶呤和阿糖胞苷交替鞏固治療以及11個周期的長春新堿和潑尼松維持治療。普納替尼組的患者在完成誘導化療并達到MRD陰性CR后,能夠以每日一次口服15mg的減少劑量接受該藥物。 該試驗的主要終點是誘導治療結束時MRD陰性CR的發生率。2次要終點包括無事件生存期、分子緩解、總體緩解率、治療失敗時間和總體生存期。 據報道,接受普納替尼治療的患者中有30%出現微小殘留病(MRD)陰性完全緩解(CR),而分配接受伊馬替尼治療的患者則為12%(風險差異,0.18;95%CI,0.08-0.28);P=.0004)。 試驗中常見的不良反應包括肝功能障礙、皮疹、頭痛、發熱、腹痛、疲勞、口腔粘膜炎、高血壓、發熱性中性粒細胞減少癥和心律失常。 根據FDA的規定,普納替尼在該適應癥中的推薦劑量為每天一次口服30mg,誘導治療結束后患者達到MRD陰性CR后減量至每天口服15mg。帕納替尼治療應繼續與化療聯合治療最多20個周期,或直至失去反應或出現不可接受的毒性。
海得康”發掘國際新藥動態,為國內患者提供全球已上市藥品的咨詢服務,更多問題,請咨詢海得康醫學顧問,電話:400-001-9769,海得康官網微信:15600654560。
【友情提示:本文僅作為參考意見。用藥期間隨時與醫生保持聯系,隨時溝通用藥情況。圖片侵權,請聯系刪除。】 |