|
甲苯磺酸索拉非尼片多吉美Sorafenib使用說明書时间:2018-04-25 作者:海得康醫學編輯劉曉曦【原创】 阅读
藥品名稱: 【通用名稱】 甲苯磺酸索拉非尼片 【商品名稱】 多吉美 【英文名稱】 Sorafenib tosylate Tablets 適應癥: 1.治療不能手術的晚期腎細胞癌。 2.治療無法手術或遠處轉移的肝細胞癌。 目前缺乏在晚期肝細胞患者中索拉非尼與介入治療如肝動脈栓塞化療(TACE)比較的隨機對照臨床研究數據,因此尚不能明確本品相對介入治療的優劣,也不明確對既往接受過介入治療后的患者使用索拉非尼是否有益(見【臨床試驗】項)。建議醫生根據患者具體情況綜合考慮,選擇適宜治療手段。 規格: 0.2g 用法用量: 推薦劑量:推薦服用索拉非尼的劑量為每次0.4g(2×0.2g)、每日2次,空腹或伴低脂、中脂飲食服用。 服用方法 口服,以一杯溫開水吞服。 治療時間 應持續治療直至患者不能臨床受益或出現不可耐受的毒性反應。 劑量調整及特殊使用說明 對疑似不良反應的處理包括暫停或減少索拉非尼用量,如必需,索拉非尼的用量減為每日一次或隔日一次,每次0.4g(2×0.2g)。 表一列出了根據皮膚毒性做相應的劑量調整的建議: 表1:根據皮膚毒性進行劑量調整
特殊人群 兒童患者 尚無兒童患者應用索拉非尼的安全性及有效性資料。 老年人(65歲以上):性別和體重 不需根據患者的年齡(65歲以上)、性別或體重調整劑量。 肝損害患者 輕度到中度肝損害患者(Child-Pugh A和B)無需調整劑量。尚未進行重度肝損害患者(Child-Pugh C)應用索拉非尼的研究。 腎損害患者 輕度到中度腎功能損害的患者無需調整劑量。尚無重度腎功能損害或進行透析的患者應用索拉非尼的研究。 不良反應: 以下數據主要來自本品在晚期肝細胞癌和晚期腎細胞癌臨床試驗中獲得的安全性數據,包括歐美和亞洲國家的數據(見【臨床試驗】項下) 因為臨床試驗是在廣泛多樣的條件下進行的,在某個臨床試驗中觀察到的不良反應發生率不能再其他臨床試驗中的發生率進行直接比較,也不嫩反映實際觀察到的發生率。 歐美關鍵性的支持本品上市的臨床研究的安全性數據: 最常見的不良反應有腹瀉、皮疹、脫發和手足皮膚反應(國際醫學用語詞典(MedDRA)對應為手足感覺不良綜合征)。 表2來自于試驗11213中索拉非尼作為單一藥物治療的451位腎癌患者與451位使用安慰劑的腎癌患者(以白種人為主,包括少數非裔、亞裔、西班牙人及其他人種) 表2:試驗11213在一治療組至少5%患者出現的不良反應 (采用國立癌癥研究所常見毒性反應術語及分級標準NCI CTCAE 3.0版)
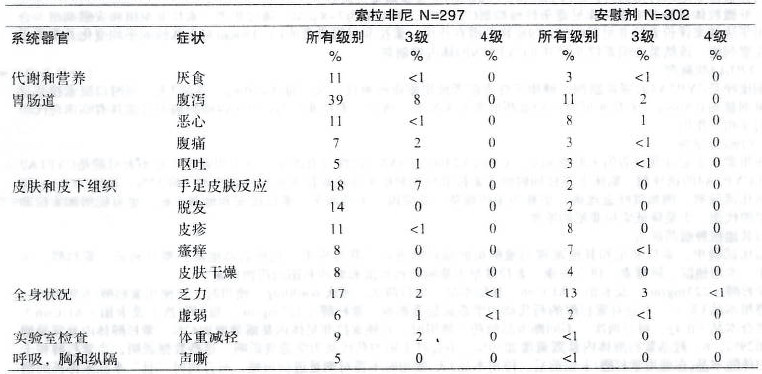
表3來自于試驗100554中索拉非尼作為單一藥物治療的297位肝細胞癌患者和使用安慰劑治療的302位肝細胞癌患者的安全性數據(以白種人為主,包括少數非裔、亞裔和西班牙人)。 表3:試驗100554任一治療組至少5%患者出現的不良反應 (采用國立癌癥研究所常見毒性反應術語及分級標準NCI CTCAE 3.0版)
表4列出了多個臨床試驗中根據不同系統器官(MedDRA)和發生頻率報告的藥物相關的不良事件(按照歐洲藥品管理局(EMEA)人用藥品委員會(CHMP)關于藥品說明書的指導原則)。發生率定義為:很常見(≥1/10),常見(≥1/10),常見(≥1/100,<1/10),不常見(≥1/1000,<1/100),稀少(≥1/10000,<1/1000),罕見(≥1/10000,<1/1000),未知(不能根據已有數據進行評價)。 在每個發生率組,不良反應按嚴重程度降序排列。
一項包括638名接受索拉非尼治療患者(包括202名腎細胞癌患者,137名肝細胞癌患者和299名其他癌癥患者)的II期臨床研究中也對安全性進行了評估。 在接受索拉非尼治療的患者中,被報告的最常見的藥物相關不良事件是皮疹(38%),腹瀉(37%),手足皮膚反應(35%)和乏力(33%)。在接受索拉非尼治療的患者中,CTCAE(2.0版)3級和4級的藥物相關的不良事件發生率分別為37%和3%。 幾種藥物不良反應的更多信息 充血性心力衰竭:在Bayer公司申辦的臨床研究中,服用索拉非尼患者充血性心力衰竭的發生率為1.9%(N=2276)。在11213研究中(腎癌研究),所報告的充血性心力衰竭的發生率在索拉非尼組和安慰劑組中分別為1.7%和0.7%。在100554研究(肝癌研究)中,索拉非尼組和安慰劑組患者充血性心力衰竭的發生率分別為0.99%和1.1%。Bayer公司申辦的一項 在III B-IV期非小細胞肺癌(NSCLC)患者中比較卡鉑與紫杉醇+/-索拉非尼療效與安全性的隨機對照研究由于數據監查委員會得出該研究不能達到其延長總生存的主要終點指標而提前終止。該研究中的安全性事件與之前的研究所報告的一致。而在肺鱗癌患者中接受索拉非尼加卡鉑加紫杉醇者死亡率高于僅接受卡鉑加紫杉醇(HR 1.81,95% CI 1.19-2.74)。這一結果的確切原因仍不清楚。 實驗室檢查異常 在腎細胞癌患者中的實驗室檢查異常(試驗11213): 服用索拉非尼后通常會出現脂肪酶和淀粉酶升高。在研究11213中,索拉非尼組12%的患者為CTCAE 3或4級脂肪酶升高,安慰劑組為7%。索拉非尼組有1%的患者出現CTCAE 3或4級淀粉酶升高,安慰劑組為3%。在研究11213中,451例服用索拉非尼的患者發生胰腺炎有2例(CTCAE 4級)而安慰劑組451例有1例發生(CTCAE 2級)。 低磷血癥是很常見的實驗室檢查異常,在索拉非尼組中的發生率為45%,在安慰劑組中的發生率為11%。CTCAE 3級低磷血癥(1-2mg/dL)在索拉非尼組中的發生率為13%,在安慰劑組中的發生率為3%。索拉非尼組和安慰劑組均未報告CTCAE4級的低磷血癥(<1mg/dL)病例。低磷血癥與索拉非尼的病因學關系尚不明確。 CTCAE 3級和4級淋巴細胞減少在索拉非尼組中的發生率為13%,在安慰劑組中的發生率為7%;中性粒細胞減少在索拉非尼組中的發生率為5%,在安慰劑組中的發生率為2%;貧血在索拉非尼組中的發生率為2%,在安慰劑組中的發生率為4%;血小板減少在索拉非尼組中的發生率為1%,在安慰劑組中的發生率為0%。 在肝細胞癌患者中的實驗室檢查異常(試驗100554): 脂肪酶升高在索拉非尼組中的發生率為40%,在安慰劑組中的發生率為37%。兩組均有9%的患者出現CTCAE 3級或4級脂肪酶升高。淀粉酶升高在索拉非尼組中的發生率為34%,在安慰劑組中的發生率為29%。兩組均有2%的患者被報告出現CTCAE 3級或4級淀粉酶升高。許多病例的脂肪酶和淀粉酶升高是短暫的,并且多數病例沒有因此中斷索拉非尼治療。297例服用索拉非尼的患者中有1例發生胰腺炎(CTCAE 2級)。 低磷血癥是常見的實驗室檢查異常。該癥在索拉非尼組中的發生率為35%,在安慰劑組中的發生率為11%;CTCAE 3級磷血癥(1-2mg/dL)在索拉非尼組中的發生率為11%;在安慰劑組中的發生率為2%。安慰劑組報告1例CTCAE 4級低磷血癥(<1 mg/dL)。低磷血癥與索拉非尼的病因學關系尚不明確。 在試驗組和對照組之間,肝功能檢測指標的升高情況相當。AST(天門冬氨酸氨基轉移酶)升高在索拉非尼組中的發生率為94%,在安慰劑組的發生率為91%。CTCAE 3級或者4級的AST升高在索拉非尼組中的發生率為16%,在安慰劑組為17%。ALT(丙氨酸氨基轉移酶)升高在索拉非尼組中的發生率為69%,在安慰劑組為68%。CTCAE 3級或4級的ALT升高在索拉非尼組中的發生率為3%,在安慰劑組中的發生率為8%。膽紅素升高在索拉非尼組中的發生率為47%,在安慰劑組中的發生率為45%。CTCAE 3級或4級的膽紅素升高在索拉非尼組中的發生率為10%,在安慰劑組中的發生率為11%。血清白蛋白降低在索拉非尼組中的發生率為59%,在安慰劑組中的發生率為47%。兩組中均未觀察到CTCAE 3級或4級的血清白蛋白降低。 堿性磷酸酶升高在索拉非尼組中的發生率為82.2%,在安慰劑組中的發生率為82.5%。CTCAE 3級的堿性磷酸酶升高在索拉非尼組中的發生率為6.2%,在安慰劑組中的發生率為8.2%。兩組均未觀察到CTCAE 4級的堿性磷酸酶升高。 INR升高在索拉非尼組中的發生率為42%,在安慰劑組中的發生率為34%。CTCAE 3級的INR升高在索拉非尼組中的發生率為4%,在安慰劑組中的發生率為2%。兩組中均未觀察到CTCAE 4級的INR升高。 淋巴細胞減少在索拉非尼組中的發生率為47%,在安慰劑組中的發生率為42%。CTCAE 3級或4級的淋巴細胞減少在兩組中的發生率均為6%。 中性粒細胞減少在索拉非尼組中的發生率為11%,在安慰劑組中的發生率為14%。CTCAE 3級或4級的中性粒細胞減少癥在兩組中的發生率均未1%。 貧血在索拉非尼組中的發生率為59%,在安慰劑組中的發生率為64%。CTCAE 3級或4級的貧血在兩組中的發生率均為3%。 血小板減少在索拉非尼組中的發生率為46%,在安慰劑組中的發生率為41%。CTCAE 3級或4級的血小板減少癥在索拉非尼組中的發生率報告為4%,在安慰劑組中的發生率小于1%。 亞洲人安全性數據: 試驗11515是在日本進行的一項非隨機、非對照、開放的索拉非尼治療晚期腎細胞癌的II期臨床研究,共有131名患者至少接受過一次索拉非尼治療。與歐美關鍵的臨床研究相比較,試驗中報告的與藥物相關的不良事件是相似的,最常見的有:脂肪酶升高(56.5%),脫發(38.9%),淀粉酶升高(38.2%),皮疹/脫屑(37.4%)和腹瀉(33.6%)。 試驗11559是一項在亞洲進行的索拉非尼治療晚期腎細胞癌的多中心、非隨機的III期臨床研究,包括中國大陸和臺灣。在所有的至少接受過一次索拉非尼治療的39名患者中,36名患者(92.3%)發生了與藥物相關的不良事件,常見的為手足皮膚反應(64.1%),脫發(35.9%),腹瀉(28.2%),疼痛(23.1%),乏力(20.5%)等。表5列出了發生率至少5%、≥3級的藥物相關不良事件。 在所有接受治療的患者中,10例患者共發生16起嚴重不良事件(SAE),其中3例患者的5起事件,經研究者和拜耳公司總部判斷與研究藥物有關,但嚴重程度均≤CTCAE 3級。 表5:試驗11559中發生率至少5%,≥3級藥物相關不良事件(安全性人群分析)
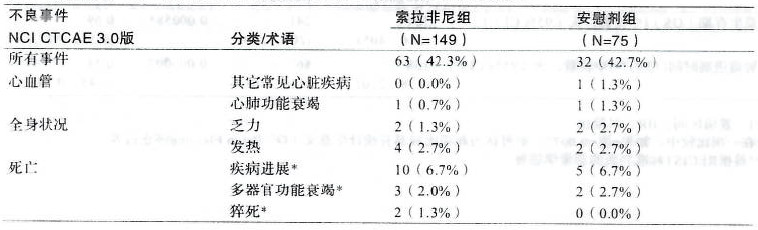
試驗11849是一項在亞洲進行的索拉非尼治療晚期肝細胞癌的國際多中心、隨機、安慰劑對照的III期臨床試驗,包括中國大陸、臺灣和韓國。在所有的至少接受過一次索拉非尼治療的149名患者中,121名患者(81.2%)發生了與藥物相關的不良事件。除惡心和嘔吐外,研究者判斷與藥物相關的不良事件在索拉非尼組患者發生率明顯高于安慰劑組。索拉非尼組最常見的5種藥物相關不良反應事件依次為:手足皮膚反應(44.3%)、脫發(24.2%)、腹瀉(22.8%)、皮疹(18.8%)和乏力(18.8%)。表6所列為研究中所觀察到的發生率≥5%的與藥物相關的不良反應事件。 表6:試驗11849中治療期間任一組發生率≥5%的與藥物相關的不良事件
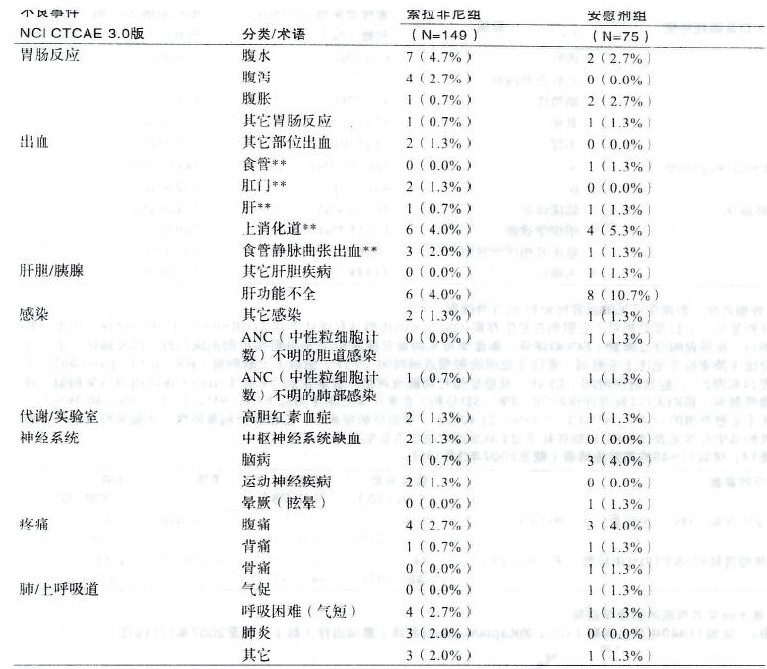
截至2007年3月19日,該試驗中共發生嚴重不良事件95例,安慰劑組32例(42.7%),索拉非尼組63例(42.3%),兩組患者發生率相近。其中經研究者判斷與治療相關的嚴重不良事件共20例,安慰劑組1例(1.3%),索拉非尼組19例(12.7%)。除2例上消化道出血(4級)和1例肺炎(5級)外,其余與索拉非尼相關的嚴重不良事件均≤CTCAE 3級。表7為與索拉非尼相關的嚴重不良事件。 表7:試驗11849中任一治療組治療期間至少1%患者出現的嚴重不良事件發生率
禁忌: 對索拉非尼或藥物的非活性成分有嚴重過敏癥狀的患者禁用。
注意事項: 本品必須在有使用經驗的醫生指導下服用。 目前缺乏在晚期肝細胞癌患者中索拉非尼與介入治療如TACE比較的隨機對照臨床研究數據,因此尚不能明確本品相對介入治療的優勢,也不能明確對既往接受過介入治療后患者使用索拉非尼是否有益(見【臨床試驗】項)。建議醫生根據患者具體情況綜合考慮,選擇適宜的治療手段。 妊娠:育齡婦女在治療期間應注意避孕。應告知育齡婦女患者,藥物對胎兒可能產生的危害,包括嚴重畸形(致畸性),發育障礙和胎兒死亡(胚胎毒性)。孕期應避免應用索拉非尼。只有治療收益超過對胎兒產生的可能危害時,才能應用于妊娠婦女。 在動物實驗中已經發現索拉非尼有致畸性和胚胎-胎兒毒性(包括流產危險增加、發育障礙),并且這些危害作用在明顯低于臨床劑量時即出現。基于索拉非尼對多種激酶抑制的機理和動物實驗結果,從而推測孕婦服用索拉非尼會危害胎兒。 哺乳期婦女在索拉非尼的治療期間應停止哺乳。 皮膚毒性:手足皮膚反應和皮疹是服用索拉非尼最常見的不良反應。皮疹和手足皮膚反應通常多為NCI CTCAE 1級到2級,且多于開始服用索拉非尼后的6周內出現。對皮膚毒性反應的處理包括局部用藥以減輕癥狀,暫時性停藥或/和對索拉非尼進行劑量調整。對于皮膚毒性嚴重或反應持久的患者需要永久停用索拉非尼。 高血壓:服用索拉非尼的患者高血壓的發病率會增加。高血壓多為輕到中度,多在開始服藥后的早期階段就出現,用常規的降壓藥物即可控制。應定期監控血壓,如有需要則按照標準治療方案進行治療。對應用降壓藥物后仍嚴重或持續的高血壓或出現高血壓危象的患者需考慮永久停用索拉非尼。 出血:服用索拉非尼治療后可能增加出血的機會。嚴重出血并不常見。一旦出血需治療,建議考慮永久停用索拉非尼。 華法林:部分同時服用索拉非尼和華法林治療的患者偶發出血或INR升高。對合用華法林的患者應定期監測凝血酶原時間的改變、INR值并注意臨床出血跡象。 傷口愈合并發癥:服用索拉非尼對傷口愈合的影響未進行正式的研究。需要做大手術的患者建議暫停索拉非尼,手術后患者何時再應用索拉非尼的臨床經驗有限,因此決定患者再次服用前應先從臨床考慮,確保傷口愈合。 心肌缺血和/或心肌梗死:在試驗11213中,治療相關的心機缺血/心肌梗死在索拉非尼組的發生率(2.9%)高于安慰劑組(0.4%)。在試驗100554中,治療相關的心機缺血/心肌梗死在索拉非尼組的發生率為2.7%,在安慰劑組的發生率為1.3%。不穩定的冠心病患者和近期的心肌梗死患者沒有入組這兩項試驗。對于發生心肌缺血和/或心肌梗死的患者應考慮暫時或永久停用索拉非尼的治療。 QT間期延長:據報道顯示,索拉非尼可延長QT/QTc間期,可致室性心律失常風險增加。一項臨床藥理學研究中,對31名患者進行基線(治療前)和治療后QT/QTc測定。經過一個28天的治療周期,在索拉非尼體內濃度最高的時刻,與安慰劑治療的基線相比,QTcB被延長了4±19msec,而QTcF被延長了9±18msec。在治療后進行的心電圖(ECG)監測中,沒有任何患者出現QTcB或QTcF大于500msec。因此,對患有或可能發展為QTc間期延長的患者(例如先天性QT延長綜合征的患者,以蒽環類抗生素高累積劑量治療的患者,服用抗心律失常藥物或其他導致QT延長藥物,電解質紊亂如低鉀血癥、低鈣血癥或低鎂血癥的患者)應謹慎使用索拉非尼。當上述患者使用索拉非尼時,應考慮定期監測治療期心電圖和電解質(鎂、鉀、鈣)。 胃腸道穿孔:胃腸道穿孔較為少見。在服用索拉非尼的患者中報告出現胃腸道穿孔的不足1%。在一些病例中,胃腸道穿孔和腹腔內腫瘤無關。應停止本品治療(見【不良反應】)。 肝損害:沒有重度肝損害患者(Child-Pugh C級)服用索拉非尼的研究資料。由于索拉 非尼主要是經肝消除,其在肝功能嚴重受損的患者中的暴露量會升高。 藥物-藥物相互作用: UTG1A1途徑:建議索拉非尼和通過UTG1A1代謝/清除的藥物(如伊立替康)聯合應用時,需謹慎(見【藥物相互作用】)。 多西他賽:既往研究結果顯示,多西他賽(75 mg/m2或100 mg/m2)與索拉非尼(0.2g或0.4g每日兩次給藥)聯合應用時(索拉非尼在多西他賽用藥時停用三天),可導致多西他賽的AUC增加36%-80%。建議本品與多西他賽聯合應用時,需謹慎(見【藥物相互作用】)。 新霉素:與新霉素聯用時可導致索拉非尼生物利用度下降(見【藥物相互作用】)。 對駕駛和機器操作的影響:目前尚無索拉非尼對駕駛和機器操作的影響的研究。沒有證據顯示索拉非尼會影響駕駛和機器操作能力。
孕婦及哺乳期婦女用藥: 妊娠 尚無妊娠期婦女服用索拉非尼的足夠臨床資料。動物實驗表明藥物存在生殖毒性包括致畸性。索拉非尼和其代謝物可通過大鼠的胎盤屏障,推測索拉非尼可抑制胎兒的血管生成。 育齡婦女在治療期間應注意避孕。如在孕期應用索拉非尼,應告知患者藥物對胎兒可能產生的危害,包括嚴重畸形(致畸性),發育障礙和胎兒死亡(胚胎毒性)。 孕期避免應用索拉非尼。只有治療收益超過對胎兒產生的可能危害時,才應用于妊娠婦女(見【注意事項】)。 育齡婦女 動物實驗表明索拉非尼具有致畸性和胚胎毒性。治療期間和治療結束至少2周內應采取足夠的避孕措施。 哺乳 目前尚未知索拉非尼是否可進入人類乳汁。動物實驗表明索拉非尼和/或其代謝常務可進入到乳汁中。由于很多藥物從乳汁中分泌,并且索拉非尼對嬰兒的作用尚未研究,因此婦女在該藥治療期間應停止哺乳。 生殖能力 動物實驗結果表明索拉非尼可損害男性和女性的生殖能力。
兒童用藥: 尚無兒童患者應用索拉非尼的安全性有效性資料。
老年用藥: 不需根據患者的年齡(65歲以上)調整劑量。
藥物相互作用: CYP3A4誘導劑:尚無CYP3A4誘導劑影響索拉非尼藥物代謝的臨床資料。CYP3A4誘導劑(如利福平、貫葉連翹(或貫葉金絲桃,俗稱圣約翰草)、苯妥英、卡馬西平、苯巴比妥和地塞米松)可能加快索拉非尼的代謝,因此降低索拉非尼的藥物濃度。 CYP3A4抑制劑:酮康唑是CYP3A4的強抑制劑,健康男性志愿者使用酮康唑每日一次連續7天,同時口服索拉非尼單劑量每日50 mg,索拉非尼的平均AUC并未改變。所以CYP3A4抑制劑影響索拉非尼代謝的可能性很小。 CYP2C9底物:華法林是CYP2C9的底物,通過比較服用索拉非尼和安慰劑的患者來評估索拉非尼對華法林的影響。與安慰劑組相比索拉非尼合用華法林的患者的平均PT-INR值并未改變。但患者合用華法林時應定期監測INR值。 CYP同工酶選擇性底物:咪達唑侖、右美沙芬和奧美拉唑分別為細胞色素CYP3A4、CYP2D6和CYP2C19的底物。索拉非尼與上述三種藥物聯合應用不會改變它們的暴露量。這表明對于細胞色素P450的同工酶,索拉非尼既不是抑制劑也不是誘導劑。在一項臨床試驗中,本品與紫杉醇聯合用藥導致6-羥基紫杉醇(由CYP2C8代謝的紫杉醇活性代謝物)體內暴露量的增加,而不是下降。這些數據表明本品可能不是CYP2C8的體內抑制劑。 和其他抗腫瘤藥物的相互作用:臨床試驗中,索拉非尼和其他常規劑量的抗腫瘤藥物進行了聯合應用,包括吉西他濱,奧沙利鉑,紫杉醇,卡鉑,卡培他濱,阿奇素,伊立替康和多西他賽。索拉非尼不影響吉西他濱和奧沙利鉑的藥物代謝。 紫杉醇(225 mg/m2)及卡鉑(AUC=6)伴隨本品(每日兩次,每次≤400 mg)使用時(在使用紫杉醇/卡鉑前后,停用本品3天),不會對紫杉醇的藥代動力學造成顯著影響。紫杉醇(225 mg/m2,每3周1次)及卡鉑(AUC=6)聯合本品(0.4g,每日兩次,不間斷本品給藥)使用時,致使索拉非尼體內暴露量增加47%,紫杉醇體內暴露量增加29%,6-羥基紫杉醇體內暴露量增加50%。不會對卡鉑的藥代動力學造成影響。這些數據表明,當紫杉醇和卡鉑伴隨本品(在使用紫杉醇/卡鉑前后,停用本品3天)使用時不需對劑量進行調整;而在合用并且本品未停用的情況下,本品和紫杉醇體內暴露量增高對臨床的意義尚未知。 卡培他濱(750 mg/m2–1050 mg/m2,每日2次,每21天為周期,于第1天-14天給藥)聯合本品(200 mg或400 mg,每天2次,不間斷給藥)給藥時,沒有導致本品體內暴露量的顯著改變,但卡培他濱體內暴露量有15%-50%的增加,5-FU的體內暴露量有0%-52%的增加。卡培他濱和5-FU體內暴露量輕度至中度的增加,其臨床意義尚未知。 索拉非尼和阿霉素聯合應用時可引起患者體內阿霉素的AUC值增加21%。索拉非尼和伊立替康合用時,由于伊立替康活性代謝物SN-38通過UTG1A1酶途徑進一步代謝,兩者合用導致SN-38的AUC升高67%-120%,同時伊立替康的AUC值升高26%-42%。與此相關的臨床意義尚未知。 多西他賽(75 mg/m2 或100 mg/m2,每21天一次)與索拉非尼(在21天治療周期中,從第2天到第19天,0.2g或0.4g每日兩次給藥)聯合應用時(索拉非尼在多西他賽用藥時停用三天),可導致多西他賽的AUC增加36%-80%,Cmax提高16%-32%。建議本品與多西他賽聯合應用時,需謹慎。 新霉素:新霉素是一種用于根除消化道菌叢的非全身吸收抗生素,它通過影響索拉非尼的肝腸循環(見臨床藥理學,代謝與清除)致索拉非尼的暴露量下降。健康志愿者中,接受5天新霉素治療后,索拉非尼的平均生物利用度下降了54%。這種下降的臨床意義尚不清楚。尚未對其他抗生素的效應進行研究,抗生素致索拉非尼暴露量下降效應很可能與其削弱葡糖醛酸糖苷酶活性有關。 藥物過量: 尚無索拉非尼服用過量的特殊治療措施。 索拉非尼的最高劑量為0.8g,每日兩次,在此劑量下所觀察到的主要不良反應為腹瀉和皮膚毒副反應。 如懷疑服用過量,則應停藥并對患者進行密切觀察和相應的支持治療。 貯藏: 低于25℃密封保存。請將藥品放置在兒童觸及不到的地方。 包裝: 60片/盒,鋁鋁包裝。 有效期: 30個月 |